| 西元年份 | 2025 |
|---|---|
| 出刊月份 | 9月 |
| 季刊期別 | 7 |
| 文章標題 | 研究者自行發起研究案常見稽核發現 (一) |
| 文章內文 | 研究者自行發起研究案常見稽核發現 (一)
文 / 陳玉夏1、徐偉勛2、盧彥伸2、劉俊人3
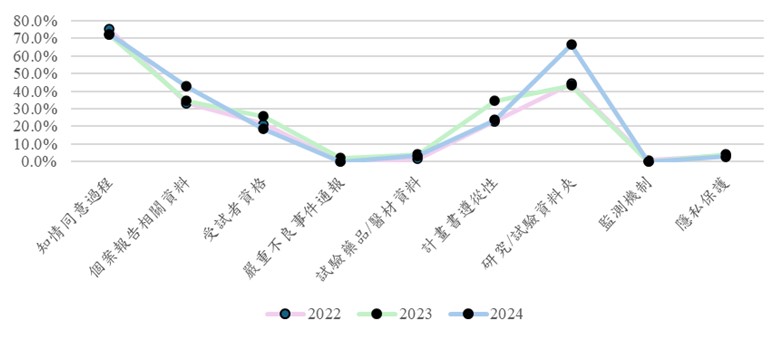
壹、前言本院為確認臨床研究執行之品質,派員核對臨床研究之資料、設備、執行過程,包含被審核之程序及被監測的程序,以確認執行臨床研究的過程是否符合相關法規。稽核小組成員依照臺大醫院倫理中心之「研究倫理委員會的稽核與查核」[1]、「臨床研究稽核計畫標準作業程序」[2]及醫學研究部之「臨床研究稽核施行細則」[3]等辦法完成稽核後,定期將稽核發現進行彙整與分析。為能了解不同類型之研究案缺失分布之差異,稽核發現將所有研究案依計畫類型分為「研究者自行發起」及「有試驗委託者」共二類,本篇重點將針對研究者自行發起研究案稽核發現進行分析與說明。 貳、研究者自行發起研究稽核發現稽核團隊於實地稽核完成後將所有臨床研究稽核發現依照稽核發現之內容將其稽核發現歸類,其項目分別為:知情同意過程、個案報告相關資料、受試者資格、嚴重不良事件通報、試驗藥品/醫材資料、計畫書遵從性、研究/試驗資料夾、試驗監測、隱私與機密保護及其他等十項不同類別之稽核發現。 分析過去三年研究者自行發起研究案之前五大稽核發現(如圖一),依序為「知情同意過程」、「研究/試驗資料夾」、「個案報告相關資料」、「計畫書遵從性」及「受試者資格」等項目。知情同意過程相關規範與改善方案已於倫理中心季刊第2期及第3期有詳盡的介紹,後續將逐一針對常見稽核發現進行分析與說明。
圖一 2022至2024年度稽核發現發生率 一、 研究/試驗資料夾 試驗資料夾,在機構中亦可稱為試驗機構文件(Investigator Site File,ISF),置入之文件依照不同計畫書內容,須置入之資料亦不同。其內容主要參考 ICH-GCP[4]中之精神,確保試驗相關資料準確、完整,並且用以確保試驗過程中或結束後能被監測、稽核或查核的一套完整文件。若將研究/試驗執行過程分為開始前與執行中二個時間點,試驗開始前的文件須包含:試驗計畫(Protocol)/同意書(ICF)與所有變更之修訂版、主持人手冊(Investigator’s Brochure,IB)、主管機關及研究倫理委員會(REC)核准文件、研究團隊成員履歷與資格證明、研究團隊成員名單與授權表(Delegation Log)、試驗啟動會議紀錄及研究訓練紀錄(Training log)、合約、保險證明、檢驗檢查相關文件、試驗用藥/醫療器材相關文件等。試驗執行中之文件包含:Protocol及ICF變更之修訂版、IB之修訂版、主管機關及REC之變更核准文件、受試者篩選或受試者清冊(Screening/Enrollment Log)、不良事件/嚴重不良事件(AE/SAE)紀錄或通報文件、監測記錄(Monitoring visit log)或監測後往返信件等。除上述資料外,亦需參考計畫書內容置入相關之文件。 回溯過去三年研究者自行發起研究案中,研究/試驗資料夾常見稽核發現有:未保存所有送審各版本之資料(如計畫書、同意書、問卷等);研究團隊未保存主管機關及研究倫理委員會(REC)核准文件,或未置入上述單位提供給主持人之版本,僅保存收件者為試驗委託廠商之版本;未設置研究授權表或研究教育訓練表等文件,或其內容未含括所有研究團隊成員及人員異動未即時更新;未保存研究相關儀器 / 醫療器材等紀錄,如各項檢驗正常值、檢查檢驗儀器說明書、校正紀錄等,或未依照說明書定期進行校正;未保存隨機分派原始資料;研究過程中或需使用低溫保存,未保存冰箱溫度記錄或運送過程記錄;受試者清冊內之個案與實際收案名單不一致,或持續審查填寫內容有誤;另亦有計畫為研究者自行發起之研究,有接受外部廠商贊助部分經費,但未於研究開始前與贊助單位完成合約簽署等。 為避免研究 / 試驗資料夾之缺失,研究團隊應於整個執行過程中,將研究 / 試驗相關規範文件置入研究 / 試驗資料夾並即時進行更新,以確保其內容為最新版資料,並且可反映研究實際過程。 二、 個案報告相關資料 綜合GCP條文中針對原始數據之規範,需要確保所報告之數據準確、完整,且可自原始資料中查證,並且要求試驗計畫書所需之數據需正確登錄於個案報告表,且與原始資料一致,亦必須完整保存原始數據。實地稽核個案報告相關資料時,其範圍包含受試者原始資料(如紙本或電子病歷)、評估表或問卷、個案報告書(case report form,CRF)或以電子數據採集系統(electronic data capture,EDC)收集之資料。多數研究者自行發起研究案未使用EDC,僅以Excel或臨床電子資料庫(REDCap)等系統登錄或收集研究資料時,由原始資料登入至上述系統之內容亦包含在案報告相關資料中。 有關「個案報告相關資料」部分,實地稽核時常發現研究團隊將「原始資料」與「個案報告書或系統」混淆,誤認為直接紀錄於CRF(EDC)或Excel之內容即為原始資料;或經常發現原始數據(病歷或問卷)與EDC/ Excel中所登錄之資料有不一致之情形;亦常發生所收集之資料多於原始核准計畫書之內容,因此造成試驗偏差之情形發生;另有研究團隊於研究過程中修改評估量表或問卷時,未先經研究倫理委員會許可,亦造成違規。 為避免個案報告相關資料之缺失,研究團隊應確保原始資料之妥善保存,且與研究 / 試驗相關之記錄皆須紀錄於原始資料中;另鍵入或轉錄至EDC/ Excel系統中之內容需與原始資料一致,避免因轉錄錯誤影響後續分析結果。 參、結語本文針對研究者自行發起研究案常見稽核缺失中之「研究 / 試驗資料夾」及「個案報告相關資料」二部分進行說明,研究資料之完整與正確性為反映研究管理與數據一致性之品質,因此研究團隊應強化文件即時更新、數據妥善保存與正確,以確保研究過程透明且可追溯,進而保障受試者安全,並提升研究執行與研究結果之專業與品質。 參考文獻1. 國立臺灣大學醫學院附設醫院研究倫理委員會:研究倫理委員會的稽核與查核 。 2. 國立臺灣大學醫學院附設醫院研究倫理委員會:臨床研究稽核計畫標準作業程序 。 3. 國立臺灣大學醫學院附設醫院研究倫理委員會:臨床研究稽核施行細則。 4. International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). ICH Harmonised Guideline: Integrated Addendum to ICH E6(R1) – Guideline for Good Clinical Practice E6(R2). 2016. https://www.ich.org/page/efficacy-guidelines。
|