| 西元年份 | 2025 |
|---|---|
| 出刊月份 | 12月 |
| 季刊期別 | 8 |
| 文章標題 | 研究者自行發起研究案常見稽核發現(二) |
| 文章內文 | 研究者自行發起研究案常見稽核發現(二)
文 / 陳玉夏1、徐偉勛2、盧彥伸2、劉俊人3 臺大醫院 1醫學研究部、2腫瘤醫學部、3內科部
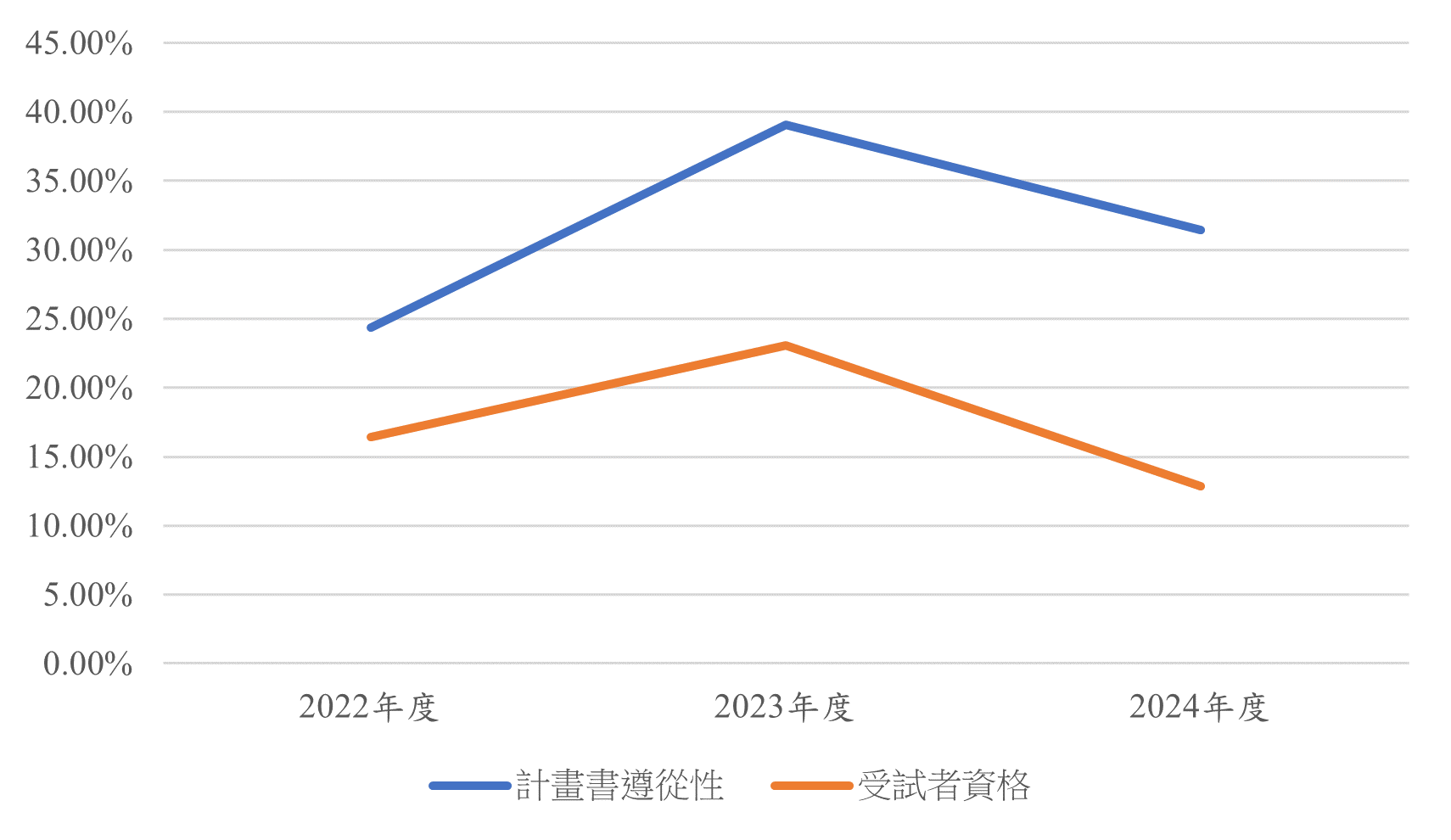
壹、前言本院為確認臨床研究執行之品質,派員核對臨床研究之資料、設備、執行過程,包含被審核之程序及被監測的程序,以確認執行臨床研究的過程是否符合相關法規。第七期倫理季刊中已針對「研究者自行發起研究案常見稽核發現」之「研究/試驗資料夾」及「個案報告相關資料」進行說明,本文將接續上期內容,將焦點著重於下列常見之稽核發現「計畫書遵從性」及「受試者資格」等項目進行詳細分析與說明。 一、計畫書遵從性 計畫書遵從性之定義為研究計畫主持人於研究計畫進行過程中,需依照審議通過之計畫書進行[1]。若於研究過程中,發現有任何事件未依審議通過之計畫書步驟進行時,則稱為試驗偏差,此時則應主動向研究倫理委員會通報試驗偏差或違規事件。過去有部分研究者誤認為研究執行之內容只要不超過計畫書範圍時即可,因此在計畫書撰寫時未多加考量研究現場實際狀態,後續執行時發現部分研究步驟無法進行時,則自行修改研究流程或內容。此時,若未即時進行計畫書變更,則會因此造成大量試驗偏差。依據計畫書遵從性之定義,研究過程應符合審議通過之計畫書進行,亦即不得多於或少於計畫書範圍。因此研究團隊進行臨床研究時,應隨時檢視經主管機關及研究倫理委員會審查通過之計畫書版本及相關送審資料,並依照研究目的及研究現場等內容視情況進行研究計畫書變更。 回溯過去三年已進行稽核之研究者自行發起研究案中,發生計畫書遵從性缺失之案件約24.3%-39.1%(如圖一),亦即被稽核之案件中約有1/3-1/4之案件有發生計畫書遵從性不足的情形。常見稽核發現有:收取之檢體範圍少於或多於計畫書內容或檢驗檢查未依照計畫書時間完成;檢體保存溫度未達標準;部分追蹤不完整或未進行、或受試者未依照計畫書載明時程回診;提供受試者填寫之評估問卷缺短或多於送審之內容;問卷版本未經研究倫理委員會許可;未依照計畫書進行隨機分派;未依照原始計畫書收納不同組別之受試者;介入之藥物或介入措施之遵從性未達計畫書規範;受試者未依照藥物服用規範;藥物調升與調降劑量未依計畫書規範進行。 雖試驗偏差有可能為無法避免之因素,如遇國定假期或重大事件及疫情等。且因近年臨床研究/試驗之內容越趨複雜,導致研究團隊執行時之困難度增加。但為避免試驗偏差,研究團隊應於撰寫計畫書時考量研究執行實際情況,並於研究開始執行前,針對所有研究團隊成員進行詳盡之教育訓練。特別於人員異動時,研究主持人須確保研究相關資料完整交接,以及新進人員確實完成完善之教育訓練。研究過程中亦需要隨時檢視計畫書及相關送審文件,若發現有需要調整之內容需盡速進行計畫書變更。
圖一 2022至2024年度「計畫書遵從性」及「受試者資格」稽核發現發生率 二、受試者資格 依據ICH GCP[2]之規範,受試者資格須事先明確訂定於試驗計畫書中,並經主管機關或研究倫理委員會審查與核准。其目的在於確保受試者之選取符合科學性、倫理性及風險效益原則,以及維護受試者之安全。研究者僅能納入符合納入與排除條件之受試者,且不得擅自放寬或變更資格標準,任何未依試驗計畫納入之情形皆屬於試驗偏差,須妥善記錄並進行通報。 雖研究開始前,納入與排除條件已明訂於計畫書中,並已經相關單位核准。但經實地稽核發現,部分研究仍可能發生納入不符合受試者資格之個案。過去三年稽核之研究者自行發起研究案中,發生受試者資格不符之案件約12.88%-23.04%(如圖一)。仔細探究其原因,多為對於納入排除之條件定義不明確,或研究團隊成員對於其納入排除條件之認知不一致,另有部分研究發生原始之納入排除條件過於嚴格導致收案不易。稽核發現有:排除條件僅說明部分「系統」,如排除心臟疾病或精神疾患,但未明確說明哪一類診斷,因此造成研究團隊遺漏排除部分診斷之個案;受試者年紀小於或超過原計畫書設定範圍;明定進入試驗前需完備之治療不足,如規範須完成四個療程之化學治療,但收納未滿四個療程之受試者納入試驗;未排除超過納入條件之狀態,如僅能收納第一期癌症之受試者,但研究團隊因收案不足,於未變更計畫書前即放寬受納第二期之個案;未明確針對條件進行評估,如排除條件規範須排除日常生活活動量表(ADL)或簡易智能狀態測驗(MMSE)未符合標準者,或需排除生命徵象不穩定者,但未確實針對該項目進行評估即納入或排除該個案等。 為避免納入不符合受試者資格之個案,研究團隊應於計畫書擬定時妥善考量各項條件。於研究開始執行前,針對所有納入及排除條件進行定義,若有需查閱病歷資料或進行進一步評估時,須備妥相關評估工具,並向所有研究團隊成員進行教育訓練。研究過程中若需更換受試者資格,需先完成計畫書變更程序後,方能進行收案。若研究過程中發現已收納不符合納入排除條件之受試者,研究團隊須立即評估受試者安全並擬定後續安全性追蹤機制,並向研究倫理委員會通報試驗偏差。 貳、結語綜合上述內容,研究者自行發起研究中,「計畫書遵從性」及「受試者資格」之稽核發現為常見且具高度風險之缺失項目,其成因多源於計畫書設計未充分貼近研究現場實務、研究團隊對規範理解不一致,以及執行過程中未即時進行計畫書變更或通報。此類缺失不僅影響研究資料之完整性與可信度,更可能對受試者安全與權益造成潛在風險。因此,研究團隊應於研究規劃階段即審慎擬定可行且明確之計畫書內容,並於研究執行前與過程中持續強化教育訓練與監測機制,確保所有研究團隊成員均能確實遵循已核准之計畫書內容規範。透過主動監測與即時修正試驗偏差,不僅可落實對受試者之倫理責任與安全保障,亦有助於提升臨床研究品質。 參考文獻
(回第8期報頁) |