撰稿人:林柏翰醫師
撰寫日期:2014-06-17
前言
好萊塢知名女星安潔莉娜裘莉,因為母親過世於卵巢癌,阿姨過世於卵巢癌,而接受基因檢測;並得知自己帶有BRCA1 基因突變,已於2013年初接受預防性雙乳房切除手術,並考慮接著接受預防性雙側輸卵管及卵巢切除手術。消息傳出,引起國際輿論矚目,並登上時代雜誌封面頭條,更成為國內外醫學界的討論熱門話題之一。不過,真正值得普羅大眾深思的,則是,是否每個人都需要面對並做下安潔莉娜裘莉的抉擇?
大多數癌症為基因後天偶發突變發生,但是有一部分族群病人(約5-10%),是因為帶有先天性的基因缺陷導致癌症發生[1]。最著名的代表即為遺傳性乳癌與卵巢癌症候群(hereditary breast and ovary cancer syndrome),促成這個症候群最重要的兩個的基因是BRCA1 與BRCA2。
遺傳基因與致癌機轉
BRCA1 與BRCA2 是1990年代在美國發現的[2]。1990年,Hall等人研究早發與遺傳性乳癌家族,經由連鎖遺傳學定律 (linkage analysis),發現染色體17q21與早發家族性乳癌有高度相關。其後1994年,Miki等人證染色體17q21上的BRCA1 基因為造成乳癌(與卵巢癌)的基因。同年,Wooster等人發現位於13q12-13也與乳癌發生相關,因而找到BRCA2 基因。BRCA1 有24個外顯子 (exons),轉譯而成的BRCA1 蛋白質共有1863個胺基酸;BRCA2 有27個外顯子 (exons),轉譯而成的BRCA2 蛋白質共有3418個胺基酸。
BRCA1 與BRCA2 這兩個基因是屬於抑癌基因 (tumor-suppressor gene),負責雙股DNA損壞的修復機轉。當細胞內雙股DNA損壞,細胞有兩個方式負責修補,第一個修復的方式稱為同源重組 (homologous recombination),另一個是非同源染色體結合 (non-Homologous end-joint),只有經由同源重組的方式來修復,雙股DNA才可以正確無誤的修復(圖2)。而BRCA1 與BRCA2 所參與的雙股DNA修復機轉,即是同源重組,因此,若這兩個基因其中之一發生缺陷,則雙股DNA受到攻擊斷裂後,會無法正確修復當細胞內DNA壞損累積到一定程度,則細胞就會發生癌變[2]。簡述其整個修復機轉,當細胞內雙股DNA損壞時,受損反應激酶 (damage-response kinase) ATM (ataxia–telangiectasia mutated) 與 ATR (ataxia–telangiectasia and Rad3–related) 就會被啟動,進而活化(磷酸化)BRCA1,使斷損的雙股DNA,進入同源重組 (homologous recombination) 的修復,有許多蛋白質參與其中,主要為Fanconi's pathway相關蛋白質,BRCA2 就是13個 Fanconi's pathway 相關蛋白質中的 FANCD1。若是在這個13個 Fanconi's pathway相關的對偶基因發生缺陷,會造成骨髓的Fanconi氏貧血、先天性疾病、白血病與癌症,當然也包含乳癌[3]。
所謂遺傳性BRCA1 與BRCA2 帶因者,定義是來自父親或是母親的生殖細胞上 (germline) 帶有BRCA1 或是BRCA2 的基因突變,也就是說在一對染色體上,有其中一條染色體上的BRCA基因是有缺陷的(另一個是好的),當人體在生長過程中,因環境或是其他因素,另一條染色體上的BRCA1 或是BRCA2 亦發生變異時,使BRCA1 或是BRCA2 的對偶基因完全喪失其功能,此時,容易發生乳癌(包括男性乳癌,BRCA2 相關)、卵巢癌、胰臟癌與攝護腺癌等。因此,遺傳學家定義BRCA1 與BRCA2 帶因者為顯性遺傳,癌發的機率亦隨著年紀上升而累積;帶有BRCA1 或是BRCA2 突變者,其乳癌等的發生年紀較一般病人早(20-30歲即開始有乳癌風險),終其一生發生乳癌的機率約到達40-87%(至70歲估計),卵巢癌的機率約到達16-60%(至70歲估計)。這兩個基因中,BRCA1 又比BRCA2 對乳癌有較重要的影響[4];若分開計算,則BRCA1 帶因者終其一生乳癌發生機率為65-80%,卵巢癌為37-62%;BRCA2 帶因者終其一生乳癌發生機率為45-85%,卵巢癌為11-23%[5]。
基因突變的判讀
傳統認知上,一個抑癌基因發生突變,其抑癌 (tumor suppression) 功能可能就喪失,因此造成癌症發生。但是,BRCA1 與BRCA2 是相當大的蛋白質,某些情形下,若只是一個不影響功能的區域發生突變,則可能不影響其本身功能。在BRCA1 與BRCA2 上,當一個基因檢測,發現有基因突變時,需要小心的判讀,有的是良性的基因變異 (benign polymorphism),與致癌無關;有的是致病性的突變 (deleterious mutation) 。然而,在BRCA1 與BRCA2 上,仍然有許多點突變位置,目前無法確定是良性或是致病性的基因變異,被歸類成未明確的變異 (variants of uncertain significance, VUS) 。舉例來說,當BRCA1 發生C端 (C-terminus) BRCT domain的刪除缺損 (deletion) 時,則BRCA1 功能缺失,為致病性的突變;又如BRCA1 發生M1775R的點突變時,也是致病性的突變;但是BRCA1 發生S1613G的點突變時,則是良性的基因變異,與致癌無關 [6] 。
BRCA基因突變相關的乳癌型態
BRCA1 突變相關的乳癌以三陰性乳癌為主 (estrogen receptor (-), progesterone receptor(-), Her2(-)),但是隨著病患年紀的增長,三陰性乳癌的比例逐漸降低,取而代之的是estrogen receptor (+)乳癌。而BRCA2 突變以賀爾蒙接受體陽性乳癌為主 (Figure 3) ,但是隨著病患年紀的增長,三陰性乳癌的比例卻是逐漸上升 [7] 。
亞洲國家與台灣資料
亞洲國家也針對此基因研究,證實BRCA1 與BRCA2 在早發乳癌占有一種要角色 [4] 。於新加坡的研究中,收集了90個家族性或是早發乳癌病人 (小於35歲),經由分子生物學檢測與電腦計算,BRCA1 與BRCA2 的帶因者高達18.9 % [10] 。在另一個中國大陸的研究,收集了139位家族性或是早發乳癌病人,BRCA1 的突變在家族性乳癌病人占了5.9 %而早發乳癌病人占了2.8 % [11]。韓國也於2007年發表206位病人的研究,共有18.4 %病人發現了BRCA1 與BRCA2 的基因突變[12]。東南亞國家(越南、菲律賓與馬來西亞)亦發表在家族性或是早發乳癌病人,4-10 %不等的BRCA1 與BRCA2 的突變機率。2009年,Hall教授等人,使用 Myraid資料庫分析BRCA1 與BRCA2 的突變機率與人種的差別,亞洲人種的突變基因機率與西歐婦女並沒有統計上的差異,其機率是相當的 [13](表1)。
表1 BRCA1 與BRCA2 之致病性與未知突變在各種族的分布比較[13]
Deleterious Mutations
| Ethnicity | No. | BRCA1 | BRCA2 | Total | OR* | No. (%Row) | OR* |
| Western European | 36,235 | 2501 (6.9) | 1899 (5.2) | 4400 (12.1) | Referent | 2081 (5.7) | Referent |
| Central European | 4066 | 366 (8.3) | 214 (5.3) | 550 (13.5) | 1.1 [1.0-1.2] | 231 (5.7) | 1.0 [0.9-1.1] |
| Latin American | 1936 | 185 (9.6) | 105 (5.4) | 290 (14.8) | 1.2 [1.1-1.4] | 195 (10.1) | 1.8 [1.6-2.2] |
| African | 1767 | 180 (10.2) | 100 (5.7) | 280 (15.6) | 1.3 [1.1-1.5] | 292 (16.5) | 3.2 [2.8-3.7] |
| Asian | 1183 | 75 (6.3) | 75 (6.3) | 150 (12.7) | 1.0 [0.9-1.2] | 161 (13.6) | 2.6 [2.2-3.1] |
| Native American | 597 | 44 (7.4) | 35 (5.9) | 79 (13.2) | 1.1 [0.9-1.4] | 41 (6.9) | 1.2 [0.9-1.7] |
| Middle Eastern | 492 | 30 (6.1) | 16 (3.3) | 46 (9.4) | 0.7 [0.5-1.0] | 55 (11.2) | 2.1 [1.6-2.7] |
| Total | 46,276 | 3351 (7.2) | 2444 (5.3) | 5795 (12.5) | - | 3057 (6.6) | - |
* [95% CI]
台灣目前並沒有大規模研究資料,早年高雄醫學大學附設醫院與彰化基督教醫院曾做過小型研究。台大醫院張金堅教授(現任澄清醫院院長)與多位乳癌醫師於多年前開始研究此一基因對台灣病人的影響[14]。當時收案36個家族,針對家族有多位乳癌或是卵巢癌之病友或是早發之乳癌病友,徵得其同意之下,從事遺傳諮詢與基因診斷,以提供其風險評估。有 4個家族 (11%) 被證實帶有BRCA1的germline突變。其中2個是遺傳密碼位移突變 (frame-shift),1個是無義突變 (non-sense mutation),另1個點突變。而這個點突變在當時國際上資料庫報告很少,分類上是屬於未明確的變異,該研究經由蛋白質結構分析與兩種功能性分析(transcription activation 與 yeast growth-inhibition assays),才推定該點突變應屬於致病性的突變,而該病人的乳癌病理組織也的確屬於三陰性乳癌,家族上也兩代多位成員發生乳癌。從該家族研究可以得知,台灣的確存在有BRCA1 的家族。
何時建議進行基因檢測?
BRCA 在媒體的報導之下,何時該檢測基因是大眾關心的議題。如同過往的研究,早發或是有家族史的乳癌病友,才會被建議進行基因檢測,由此可知,需要基因檢測的乳癌病友,是少數的族群。為了更精準的抓出BRCA 基因突變的家族,有許多研究著墨於此。從家族史中,發展出各種不同的計分方式,主要是計算家族成員中得到乳癌與卵巢癌的個數與發病年齡,有些還合併病理組織學型態計分(如三陰性乳癌之於BRCA1),舉例如modified Manchester score、BRCAPRO score與Myriad score等[15]。
參考過去本院與國外的研究,具有下列早發或是家族史的病友,我們會建議病友在乳癌專科醫師的診治之下,至基因醫學部接受癌症遺傳諮詢,清楚的了解家族性乳癌的資訊後,決定是否進行基因檢驗:
- 您是早發性乳癌(<35歲)或是雙側乳癌的患者。
- 您有≥3名女性家族成員被診斷患有乳癌(年齡:不限制)。
- ≥2的女性家族成員診斷出患有乳腺癌,其中一人被診斷時≤50歲。
- ≥1女性家族成員確診乳癌和一個家族成員確診為卵巢癌(可以是同一位家族成員)
- ≥1女家族成員<35歲確診乳癌。
- ≥1名女性家族成員確診為雙側乳癌(第一個乳癌確診時需<50歲)。
- ≥1名女性家族成員確診為卵巢癌(確診時需<40歲)。
- ≥2名女性家族成員確診為卵巢癌(年齡:不限制)。
- ≥1男性家族成員確診為乳癌(年齡:不限制)。
預防與治療
國外資料於高風險族群,如猶太人或是其他BRCA 帶因者,有大規模長期追蹤資料。簡述如下,其預防癌症方式,包含預防性雙側乳房切除、卵巢切除、影像學追蹤(位切除者),化學藥物預防等方法,對照分析為切除或追蹤者。
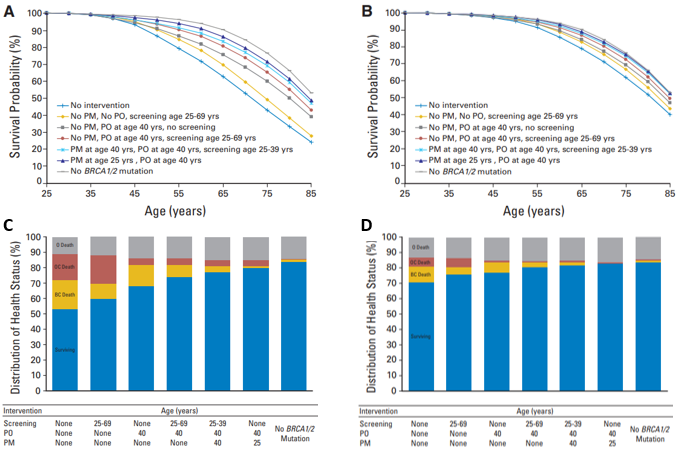
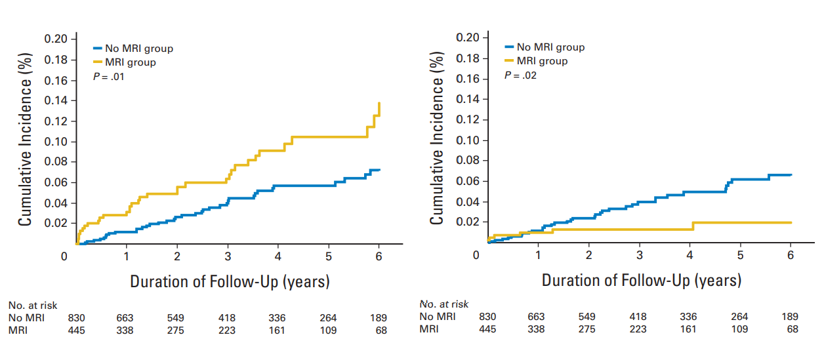
在該研究中,40歲時預防性卵巢切除可使BRCA1 帶因者增加15%絕對存活率;40歲時預防性雙側乳房切除可使BRCA2 帶因者增加7%絕對存活率。若是乳房與卵巢都切除,可使BRCA1 帶因者增加24%絕對存活率,BRCA2 帶因者增加11%絕對存活率[16,17](圖1)。但是器官切除對身心影響,也是必須考慮的重要因素,文中指出,定其影像學追蹤 (mammography plus MRI),也可以是一個合理的選擇。而另一個大規模研究也顯示,帶因者定期接受mammography與MRI追蹤,可以有效降低晚期乳癌的發生率[18](圖2)。至於化學性預防是使用自然或合成藥物來減低癌的擴散或防止再得到癌的機會。例如:一項美國國家級的乳癌研究 NSABP P-1 trial (National Surgical Adjuvant Breast and Bowel Project Breast Cancer Prevention trial ),發現常用的乳癌抗賀爾蒙藥物Tamoxifen能減低 62% BRCA2 乳癌的發生案例,不過,Tamoxifen的使用對BRCA1 的女性並無明顯預防作用[19],至於其它的化學預防還有待觀察。為何Tamoxifen僅對BRCA2 基因突變的病人有預防保護的效果,可能原因就如前段所述,因BRCA2 基因突變發生的乳癌大多為賀爾蒙接受體陽性,BRCA1 基因突變者產生的多為三陰性乳癌,因此對於抗賀爾蒙藥物自然無效。
就目前的研究資料顯示,化學性預防的效果仍不如預防性手術。目前僅被當作是高風險婦女,又不願意或無法接受預防性切除手術的替代選擇 (主要是使用Tamoxifen)。
圖1. (A與C) BRCA1,(B與D)BRCA2[17]. PO代表預防性卵巢切除,PM代表預防性乳房切除。上圖A與B中,最上頭灰色線條是不帶因者(控制組)的存活率,而上頭第二條深藍色線代表接受預防性卵巢與乳房切除者的存活率,與不帶因者相似,遠比最底下藍色線條代表BRCA 帶因者(未接受預防性手術乳房與卵巢切除也未定期篩檢)的存活率顯著上升,代表預防性切除手術的確提升帶因者的存活率。對照其死亡原因(C與D圖),黃色表示因為乳癌死亡,紅色表示因為卵巢癌死亡,灰色表示因為其他原因死亡;可見C與D圖中最左側長條圖(未接受預防性手術乳房與卵巢切除也未定期篩檢),乳癌與卵巢癌死因占一重要原因,而右側第二個長條圖(預防性卵巢與乳房切除者),乳癌與卵巢癌死因顯著下降,與不帶因者(最右側長條圖)接近。
圖2. (左圖)接受MRI檢查的BRCA 帶因者,被診斷出第0期與第一期乳癌的比例較未接受MRI檢查者高,有顯著意義。(右圖) 接受MRI檢查的BRCA 帶因者,被診斷出第二期至第四期乳癌的比例較低。該研究顯示MRI在BRCA 帶因者家族成員,可以協助乳癌的早期診斷,以提高治癒率[18]。
近年來,BRCA 一直是熱門的研究題材,在BRCA 相關的癌症方面,Fong PC等人提出了Poly (ADP-Ribose) Polymerase (PARP) 抑制劑 (inhibitor),其原理是抑制DNA的單股修復機轉(PARP inhibitor能抑制DNA的單股修復);當DNA的單股與雙股(因BRCA 突變)修復機制都失效時,使用鉑金 (cisplatin) 等化學藥物,能發揮其最大的化療效果,進而殺死腫瘤,稱之為 Synthetic lethality。該藥物在第一期與第二期人體臨床試驗,對於BRCA 突變的乳癌與卵巢癌,的確發揮療效[20]。進一步的試驗仍在進行中。
非BRCA 基因之家族性乳癌
在上述條件中之早發或是家族性乳癌,BRCA 變異帶因者只佔這些病友中的10-20%,其他基因,目前已經有較多研究的包含TP53, ATM, PALB2, BRIP1, BARD1, NBN 和CHEK2 等生殖細胞 (germline) 的變異帶因者,都可能會引發早發或家族性乳癌與其他相關的癌症。近年來,國際上大規模的研究誘發乳癌發生的原因,除了上述這些高表現率 (high penetrance) 基因之外,還有許多屬於低表現率 (low penetrance) 的單一核苷酸多型性 (Single-nucleotide polymorphism, SNP),例如位於MDM4 的rs4245739與報導三陰性乳癌相關。對於BRCA 變異帶因者乳癌的好發機率,目前也知道某些 SNP 左右BRCA 變異帶因者乳癌的發生。
非 Tumor protein p53(TP53 )基因
Tumor protein p53 (TP53) 基因(NM_000546.5)位在染色體17p13.1的位置,共含有11個外顯子,轉譯成的 p53蛋白共有393個胺基酸。和BRCA1, BRCA2 基因相同,TP53基因也是一個抑癌基因 (tumor-suppressor gene)。p53蛋白是一個全身性的核蛋白,負責調控細胞週期 (cell cycle) 和細胞凋亡 (apoptosis) 。p53蛋白直接和DNA結合,當DNA受到紫外光 (UV) 或放射線、或其他化學物質傷害,p53蛋白會使細胞週期暫停,啟動DNA修復機制,讓細胞有機會被復原,但若傷害太大,p53蛋白則進一步啟動細胞凋亡機制,以避免出DNA出錯的細胞有機會繼續分裂下去,亦避免細胞癌化的發生。TP53 基因的生殖細胞突變 (germline mutation) 會導致李弗勞明症候群 (Li-Fraumeni syndrome, LFS),這是一種顯性遺傳的癌症症候群[21]。約70%左右的LFS病人,其由父親或母親遺傳的其中一條第17號染色體,帶有突變的TP53 基因。這些基因突變會導致部分的TP53 蛋白功能缺失,當另一條帶有正常TP53 基因的染色體又發生體細胞突變 (somatic mutation),使細胞無法正常修復受損的DNA,也無法使不正常的細胞進行凋亡,就會導致早發性乳癌、腦癌、血癌、骨肉瘤、軟組織肉瘤與腎上腺皮質癌等癌症的發生。TP53 基因突變帶因的LFS病人,一生罹患癌症的機率高達90%。目前已經有超過六十種的TP53 基因突變在LFS病人被發現,大部分為點突變,發生在p53蛋白與DNA結合的位置[22]。雖然LFS病人只佔乳癌患者的一小部分 (<1%),但LFS病人容易罹患早發性乳癌,超過50%的病人在30歲以前就會被診斷出罹患乳癌。帶有TP53 基因的生殖細胞突變,使LFS病患跟正常族群比起來,在45歲以前罹患乳癌的機率高了18~60倍[23]。另一方面,約有20~30%的乳癌病患帶有TP53 基因的體細胞突變 (somatic mutation),特別是三陰性乳癌,有高達70%左右患者的患者帶有TP53 基因突變。此外,突變的種類跟乳癌的亞型很有關係,約26%的管腔乳腺癌病人帶有TP53 基因突變,但有高達88%的基底乳腺癌 (basal breast tumors) 患者,帶有TP53 基因突變[24, 25]。是否帶有TP53 基因突變,跟化療治療的敏感度也有關係,在Estroge Receptor (ER) 陰性的乳癌,TP53 基因突變帶因會增加化療的敏感度。
結語
早期乳癌目前已是『可治癒』的疾病,歷經手術與必要時輔助化學或是放射線治療階段後,大半病患可存活很長的時日。在BRCA 家族性乳癌的病友與家人,目前已知及早進行乳房篩檢甚至是預防性切除等可以有效的減少晚期乳癌或是降低死亡率,因此,對於BRCA 的家族,並不需要害怕,及早安排預防計畫便可以免除乳癌的恐懼。其他有非BRCA 等遺傳基因變異者,而具有乳癌家族史的女性朋友,也應在專科醫師的建議之下,定期接受檢查,以確保自我的健康。
參考文獻
- Schiffman JD: Hereditary cancer syndromes: if you look, you will find them. Pediatr Blood Cancer 2012; 58: 5-6.
- Venkitaraman AR: Linking the cellular functions of BRCA genes to cancer pathogenesis and treatment. Annu Rev Pathol 2009; 4: 461-487.
- Levy-Lahad E: Fanconi anemia and breast cancer susceptibility meet again. Nat Genet 2010; 42: 368-369.
- Liede A, Narod S A: Hereditary breast and ovarian cancer in Asia: genetic epidemiology of BRCA1 and BRCA2. Hum Mutat 2002; 20: 413-424.
- Balmaña J, Díez O,Castiglione M; ESMO Guidelines Working Group. BRCA in breast cancer: ESMO clinical recommendations. Ann Oncol. 2009 ;20 Suppl 4:19-20.
- SpurdleAB, Healey S, Devereau A et al.: ENIGMA--evidence-based network for the interpretation of germline mutant alleles: an international initiative to evaluate risk and clinical significance associated with sequence variation in BRCA1 and BRCA2 genes. Hum Mutat 2012; 33: 2-7.
- Mavaddat N, Barrowdale D, Andrulis IL et al.: Pathology of breast and ovarian cancers among BRCA1 and BRCA2 mutation carriers: results from the Consortium of Investigators of Modifiers of BRCA1/2 (CIMBA). Cancer Epidemiol Biomarkers Prev 2012; 21: 134-147.
- Martins FC, De S, Almendro V et al.: Evolutionary pathways in BRCA1-associated breast tumors. Cancer Discov 2012; 2: 503-511.
- Lin WT, Beattie M, Chen LM et al.: Comparison of age at natural menopause in BRCA1/2 mutation carriers with a non-clinic-based sample of women in northern California. Cancer 2013; 119: 1652-1659.
- Ang P, Lim IH, Lee TC et al.: BRCA1 and BRCA2 mutations in an Asian clinic-based population detected using a comprehensive strategy. Cancer Epidemiol Biomarkers Prev 2007; 16: 2276-2284.
- Chen W, Pan K, Ouyang T et al.: BRCA1 germline mutations and tumor characteristics in Chinese women with familial or early-onset breast cancer. Breast Cancer Res Treat 2009; 117: 55-60.
- Seong MW, Cho S, Noh DY et al.: Comprehensive mutational analysis of BRCA1/BRCA2 for Korean breast cancer patients: evidence of a founder mutation. Clin Genet 2009; 76: 152-160.
- Hall MJ, Reid JE, Burbidge LA et al.: BRCA1 and BRCA2 mutations in women of different ethnicities undergoing testing for hereditary breast-ovarian cancer. Cancer 2009; 115: 2222-2233.
- Kuo WH, Lin PH, Huang AC et al.: Multimodel assessment of BRCA1 mutations in Taiwanese (ethnic Chinese) women with early-onset, bilateral or familial breast cancer. J Hum Genet 2012; 57: 130-138.
- Evans DG, Lalloo F, Cramer A et al.: Addition of pathology and biomarker information significantly improves the performance of the Manchester scoring system for BRCA1 and BRCA2 testing. J Med Genet 2009; 46: 811-817.
- Kurian AW, Munoz DF, Rust P et al.: Online tool to guide decisions for BRCA1/2 mutation carriers. J Clin Oncol 2012; 30: 497-506.
- Kurian AW, Sigal BM, Plevritis SK. Survival analysis of cancer risk reduction strategies for BRCA1/2 mutation carriers. J Clin Oncol 2010; 28: 222-231.
- Warner E, Hill K, Causer P et al.: Prospective study of breast cancer incidence in women with a BRCA1 or BRCA2 mutation under surveillance with and without magnetic resonance imaging. J Clin Oncol 2011; 29: 1664-1669.
- Rebbeck TR, Kauff ND, Domchek SM. Meta-analysis of risk reduction estimates associated with risk-reducing salpingo-oophorectomy in BRCA1 or BRCA2 mutation carriers. J Natl Cancer Inst. 2009;101:80-7.
- Gelmon KA, Tischkowitz M, Mackay H et al.: Olaparib in patients with recurrent high-grade serous or poorly differentiated ovarian carcinoma or triple-negative breast cancer: a phase 2, multicentre, open-label, non-randomised study. Lancet Oncol 2011; 12: 852-861.